我们已经使用一次性组件成功设计了封闭式物理连接的中试规模 mAb 工艺。本文介绍了从 50 L 灌流培养进行纯化的工艺。
- 纯化工艺分为两个独立的工艺流程。一个工艺使用预填充的 ReadyToProcess MabSelect PrismA 层析柱执行捕获步骤。另一个工艺使用中试规模的 Fibro PrismA 单元。该单元是一种基于纤维的技术,可实现一次性快速循环层析。
- 在比较两个单独工艺流程的最终产品时,可以得出的结论,这两个工艺具有可比性,两个工艺流程都能产生高产量、高质量的材料,Fibro PrismA 在捕获步骤中的工艺时间更短。
- 将无菌 ReadyToProcess 构件与 ReadyMate 接头连接,成功构建了封闭工艺线。在所分析的大部分中间体中未检测到生物负荷,在收获槽下游收集的所有样品中,内毒素水平均低于检测极限。
简介
制药商正在努力争取利用更多数量的单克隆抗体 (mAb) 生成更加多元化的产品组合,而降低总体成本的关键是更好地利用设备来降低资本支出 (CAPEX) 投资。这就需要灵活的解决方案,减少设施占用空间,并最大程度地减少活动之间的转换时间。
为此,可使用不同程度的连续工艺,利用较小尺寸的层析柱和生物反应器。此策略反过来也可降低缓冲液的消耗,减小整个设施的占用空间。其他方法还包括使用一次性设备和耗材设计封闭、互联的工艺步骤,增强灵活性,并最大程度地减少对昂贵洁净室和存储空间的需求。
所述研究的目的是为通过灌流细胞培养生成的材料开发一种封闭的、物理连接的下游纯化工艺。设备和耗材主要是一次性的,是为在药品生产质量管理规范 (GMP) 环境中的生产工艺而设计的。为了比较基于填料的层析法性能与基于纤维的层析法性能,将工艺分为了两个独立的工艺流程。一个工艺使用预填充的 ReadyToProcess MabSelect PrismA 层析柱执行捕获步骤。第二个工艺使用中试规模的 Fibro PrismA 单元。该单元是一种基于纤维的技术,可实现一次性快速循环层析。本研究中使用的 Fibro PrismA 单元是 160 mL 原型单元,目前尚未推向市场。
下游工艺设计
从连续运行 10 天的 50 L 灌流细胞培养中收获要纯化的材料。日平均收获量为 70 L,平均滴度为 0.64 g/L,但两个工艺所用的时间略有不同。要了解有关上游灌流培养工艺的更多信息,请参阅此处。
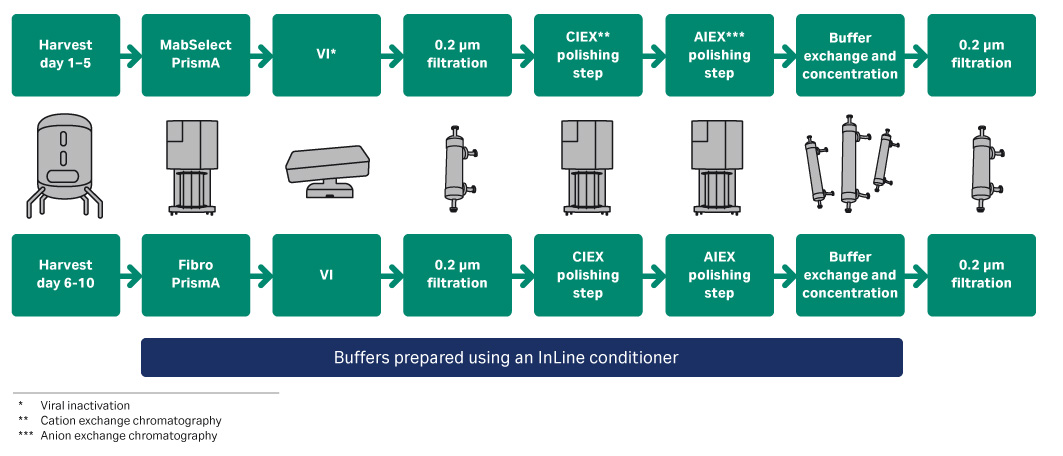
使用标准的三步 mAb 纯化工艺进行纯化。下游工艺分为两个单独的工艺流程(图 1),主要区别是在捕获步骤中,一个使用 ReadyToProcess MabSelect PrismA,另一个使用 Fibro PrismA。除了用于病毒灭活步骤的酸和碱溶液外,工艺中使用的所有缓冲液均使用在线配液 (IC) 系统从储备液制备。
图 1. 已连接的 mAb 纯化工艺的工艺流程图。
从灌流生物反应器培养第 7 天开始,在细胞密度达到稳态时,在 XDUO-200 中连续收集澄清的收获物。在培养第 8 天,将收集的收获物装到通过低流量套件连接 ÄKTA ready 的 ReadyToProcess MabSelect PrismA 0.8 L 层析柱,作为一个子批次。然后连续 5 天每天重复此过程,得到 5 个捕获的子批次(批次 1 至 5)。每个子批次中的层析柱负荷介于 57 至 59 g 抗体/升填料之间,相当于所评估的 QB10 的约 90%。
在第 6 到第 10 天(生物反应器第 13 到第 17 天),使用 160 mL Fibro PrismA 单元处理收获的材料。每个循环中的负荷约为 3.5 g 抗体(约 22 g/L 基质负荷)。在洗脱步骤开始后从 1.5 基质体积开始收集洗脱峰,并在 UV280 降至洗脱峰下坡处 200 mAu 时结束。
捕获步骤之后,在 WAVE 25 中对洗脱产品进行低 pH 值病毒灭活。灭活后的材料进行 0.2 µm 过滤并存储,留作下一步处理。在病毒灭活步骤之后,汇集材料以在精纯步骤中予以适当装载。
对于这两个工艺流程,在结合-洗脱模式下配合使用 ÄKTA ready 和 ReadyToProcess Capto S ImpAct 层析柱执行第一个精纯步骤,之后在流通模式下使用 ReadyToProcess Q 吸附器膜执行最终精纯步骤。配合使用 ÄKTA readyflux 和用于 UF/DF 的 ReadyToProcess 中空纤维膜柱对最终纯化产品进行浓缩。
材料和方法
结果
整体工艺性能
使用一次性设备和耗材实现了封闭、无菌和连接的工艺,且取得了良好的效果。在所分析的大部分中间体中均未检测到活微生物,在收集的所有样品中,内毒素水平均低于检测极限。在报告 1 CFU 的两个样品中,重复样品的结果为阴性。导致阳性结果的原因很可能是取样或测试错误,且阳性结果没有对比内毒素结果或第二份样品予以证实。
两种工艺流程的总工艺产率和纯化性能相当(表 1)。
在每日分批处理灌流收获物的所选工艺设计中,与 MabSelect PrismA 相比,Fibro PrismA 层析法大幅缩短了捕获步骤的工艺时间。
表 1. 整体工艺性能结果摘要
| 数据类型 | MabSelect PrismA 工艺流程 |
Fibro PrismA 工艺流程 |
| HCP (ppm) | 8 | 9 |
| DNA (ng/mg) | < 0.026* | < 0.026* |
| HMW (%) | 1.6 | 1.5 |
| 残留蛋白 A 渗漏水平 (ppm) | < 0.03 | < 0.03 |
| 总工艺产率 (%) | 82 | 80 |
| 生物负荷 (CFU/mL) | 0 | 0-1 |
| 内毒素 (EU/mL) | < 0.5 | < 0.5 |
| 工艺时间(捕获步骤) | 7.7 小时 (每天 1 个循环) | 3.5 小时 (每天 10 个循环) |
*低于分析方法的量化极限。
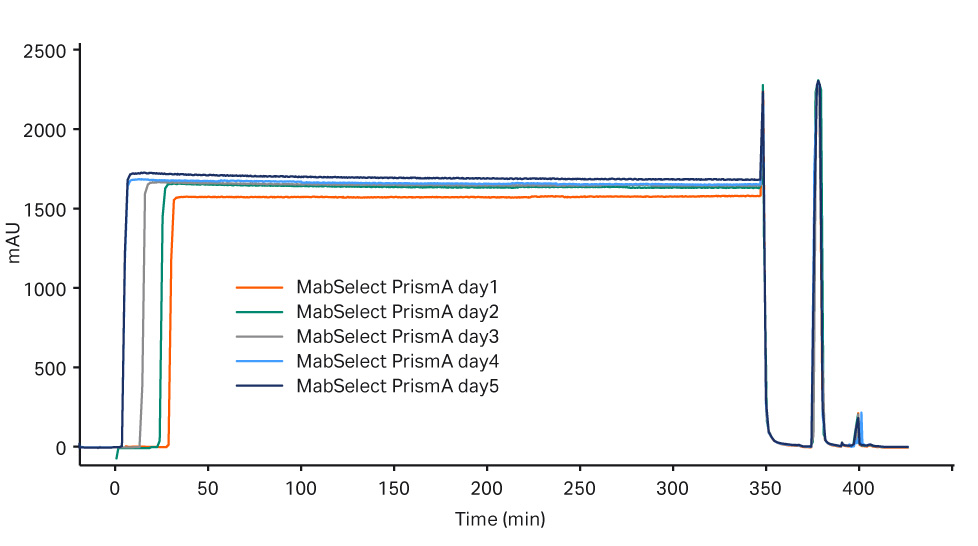
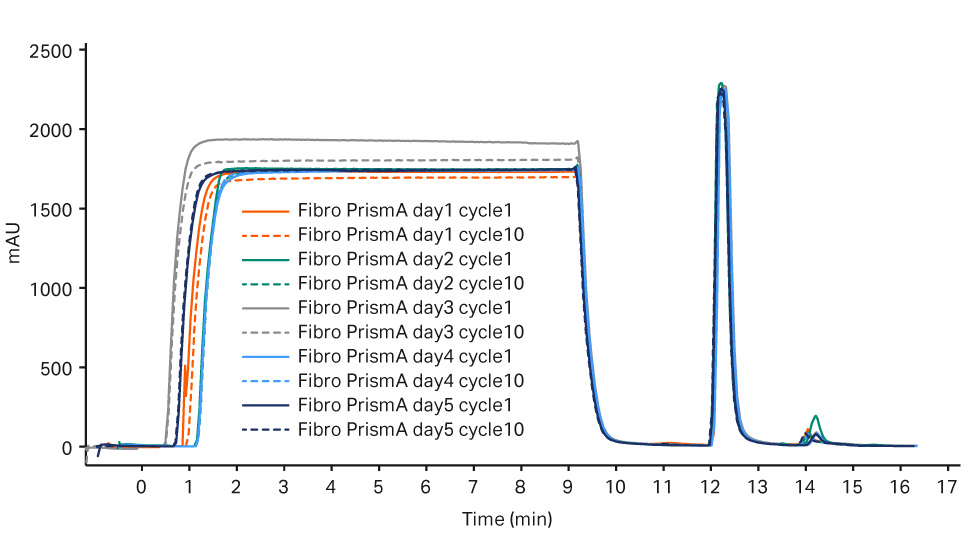
每个工艺流程五天内的纯化性能在捕获步骤中均保持一致,MabSelect PrismA 结果参见图 2,Fibro PrismA 结果参见图 3。
图 2. MabSelect PrismA 步骤第 1-5 天的层析谱叠加图。
图 3. Fibro PrismA 步骤第 6-10 天的层析谱叠加图。
工艺产率
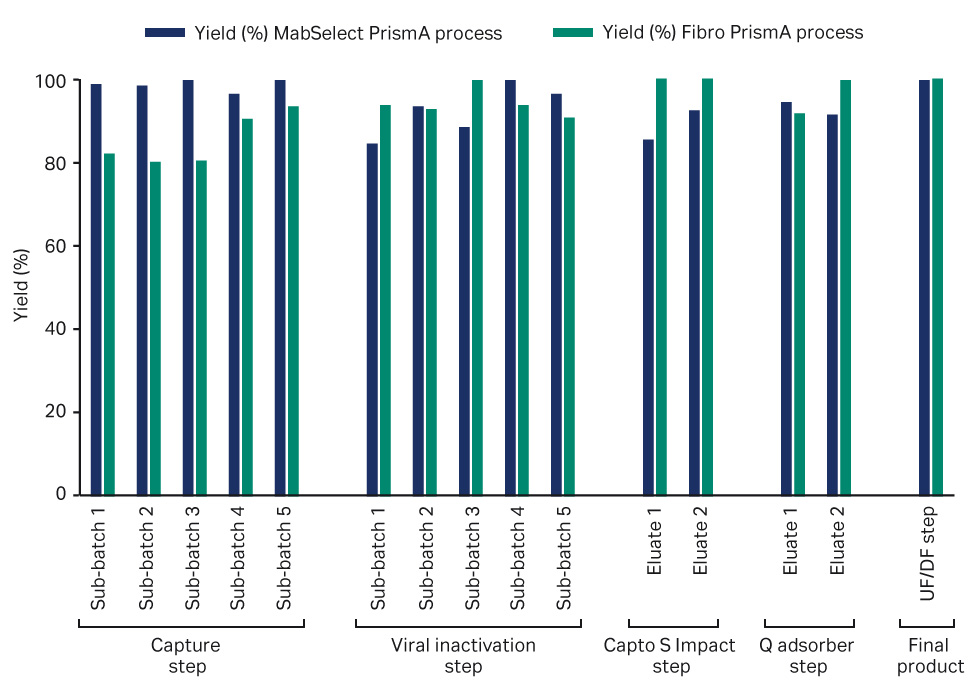
图 4 显示了两个工艺流程单元操作的产品回收率。两个工艺流程的总工艺产率相当。
在所有子批次中,捕获步骤中 MabSelect PrismA 层析柱的产率均较高。PrismA Fibro 单元的产率在不同批次之间有所不同,在五个批次中的平均回收率为 85%。回收率最低的是前三个子批次,最后两个子批次的回收率在 90% 以上。由于工艺循环时间短,需要对洗脱步骤进行进一步的优化。可以使用 ÄKTA ready 系统提供的经过调整和优化的收集条件来提高产率。
图 4. 单独单元操作期间的产品回收率。层析柱子批次为蓝色,Fibro 子批次为绿色。
MabSelect PrismA 工艺流程在病毒灭活步骤中的产率在前两个批次中较低,在后三个批次中较高。前两批的体积损失较大,可能是因为在过滤步骤中使用了表面积较大的 0.2 µm ULTA HC 滤器。Fibro PrismA 工艺流程在病毒灭活步骤中的产率在所有子批次中均很高。
结论
本研究的目的是使用一次性设备和耗材为 GMP 环境开发一种封闭、无菌、连接的 mAb 纯化工艺。下游工艺在灌流模式下连接到 50 L 生物反应器。结果表明,此方法成功实现了封闭、连接的下游工艺。整个工艺在所有时间段内始终没有出现生物负荷或内毒素问题。
结果还表明,所测试的两个工艺流程性能相当。一个工艺流程使用高载量蛋白 A 填料 MabSelect PrismA,另一个工艺流程使用 Fibro PrismA(一种快速循环的一次性层析技术)。层析填料可以实现更高的结合载量,而 Fibro 单元可以缩短工艺时间或者减少吸附剂量。由于这两种技术根据所需的结果具有不同的优势,因此,这为根据现有的设施设计、设计现在和所需的工艺结果来设计强化的 mAb 纯化工艺提供了更好的选择。
材料和方法
缓冲液制备
除了用于病毒灭活的酸液和碱液外,工艺中所用的所有缓冲液均使用 IC 系统从 HyClone 储备液制备。缓冲液由系统混合,在用于工艺之前,将 0.2 µm 的缓冲液过滤到无菌 ReadyToProcess 存储袋中,即把滤器连接到系统的出口。
系统和层析柱制备
工艺开始之前,通过 ReadyMate 一次性接头将 Flow 套件安装组件、缓冲液和产品收集袋无菌连接到 ÄKTA ready flow 套件,准备好 ÄKTA ready 层析系统。使用 ReadyMate 跨接集管增加 Flow 套件上的入口数量。在将组件安装到 ÄKTA ready 系统之前,通过无菌台上的 TC 接头将层析柱连接到 Flow 套件。安装后,完成流路和层析柱的 CIP。然后按照用于 MabSelect PrismA 捕获步骤的 5 个子批次,设置系统,并对 Fibro PrismA 步骤重复相同的步骤。对精纯步骤以同样的方式准备 ÄKTA ready 系统。
MabSelect PrismA 捕获和病毒灭活步骤
从灌流生物反应器培养的第七天开始,在细胞密度达到稳态时,在 XDUO-200 中连续收集澄清的收获物。在培养第八天时,将收集的收获物装到 ReadyToProcess MabSelect PrismA 0.8 L 层析柱,作为一个子批次。然后连续五天每天重复此过程,得到五个捕获的子批次(批次 1 至 5)。每个子批次中的层析柱负荷介于 57 至 59 g 抗体/升填料之间,相当于所评估的 QB10 的约 90%。表 2 为层析法。UV280 上升到 100 mAu 时收集洗脱峰,UV280 下降至洗脱峰下坡处 100 mAu 时停止收集
表 2. ReadyToProcess MabSelect PrismA 层析法
| 描述 | 缓冲液 | 柱体积 (CV) | 流速(停留时间) |
| 平衡 | 20 mM NaP,pH 7.0 + 0.5 M NaCl | 5 | 4 分钟 |
| 负载 | 澄清后的收获物 mAb8 | 不适用 | 4 分钟 |
| 洗涤液 1 | 20 mM NaP,pH 7.0 + 0.5 M NaCl | 5 | 4 分钟 |
| 洗涤液 2 | 50 mM 乙酸钠,pH 5.5 | 2 | 4 分钟 |
| 洗脱液 | 50 mM 乙酸钠,pH 3.5 | 3 | 4 分钟 |
| 条带 | 0.1 M HAc | 2 | 4 分钟 |
| CIP | 0.5 M NaOH | 3 | 4 分钟 |
| 再平衡 | 20 mM NaP,pH 7.0 + 0.5 M NaCl | 5 | 4 分钟 |
| 存储 | 20% EtOH | 5 | 4 分钟 |
将每个每日洗脱产品池收集在 2 L WAVE 细胞袋中进行病毒灭活。加酸,将洗脱液的 pH 值调整至 3.5 ± 0.1。轻轻摇动 60 至 75 分钟,培养 PH 值调整后的洗脱液,然后加入 2 M Tris,将 pH 值再调整至 5.0。病毒灭活步骤后,分别对子批次 1 和 2 使用 ULTA Pure HC 0.6/0.2 µm 4" 囊式滤器,对子批次 3 至 5 使用较小的 2" 滤器,对材料进行 0.2 µm 过滤,并在 2-8°C 下存储,直到执行 Capto S ImpAct 步骤。两次过滤中均未观察到压力增加。
Fibro PrismA 捕获步骤和病毒灭活
在纯化第六天(生物反应器第 13 天),将 ÄKTA ready flow 套件和层析柱换成 Fibro PrismA 160 mL 单元,以便评估和比较 Fibro 规格与层析柱规格的性能。从这个时间点开始,收集到的收获物以每天 10 个循环装到 Fibro 单元上,在病毒灭活之前汇集成一个子批次。连续五天每天重复此过程,得到五个捕获物的子批次(批次 6 至 10)。每个循环中的 Fibro 负荷约为 3.5 g 抗体(约 22 g/L 基质负荷)。表 3 为层析法。洗脱峰从设定体积 1.5 基质体积收集到洗脱模块中,直到在洗脱峰下坡 UV280 降至 200 mAu。
将每个每日洗脱产品池收集在 10 L WAVE 细胞袋中进行病毒灭活。加酸,将洗脱液的 pH 值调整至 3.5 ± 0.1。轻轻摇动 60 至 75 分钟,培养 pH 值调整后的洗脱液,然后加入 2 M Tris,将 pH 值再调整至 5.0。病毒灭活步骤后,使用 ULTA Pure HC 0.6 / 0.2 µm 4" 囊式滤器对材料进行 0.2 µm 过滤,并在 2-8°C 下存储,直到执行 Capto S ImpAct 步骤。两次过滤中均未观察到压力增加。
表 3. Fibro PrismA 层析法
| 描述 | 缓冲液 | MV | 流速 (L/h) |
| 平衡 | 20 mM NaP,pH 7.0 + 0.5 M NaCl | 5 | 39 |
| 负载 | 澄清后的收获物 mAb8 | 不适用 | 39 |
| 洗涤液 1 | 20 mM NaP,pH 7.0 + 0.5 M NaCl | 6 | 39 |
| 洗涤液 2 | 50 mM 乙酸钠,pH 5.5 | 6 | 39 |
| 洗脱液 | 50 mM 乙酸钠,pH 3.5 | 6 | 39 |
| 再平衡 | 20 mM NaP,pH 7.0 + 0.5 M NaCl | 1.5 | 39 |
| CIP | 0.5 M NaOH | 3 | 4 分钟 |
| 再平衡 | 20 mM NaP,pH 7.0 + 0.5 M NaCl | 8 | 39 |
| 存储* | 20% EtOH | 不适用 | 39 |
*仅当天的最后一个循环
Capto S ImpAct 精纯步骤和 Q 膜吸附器
分两个循环将从 ReadyToProcess MabSelect PrismA 层析柱汇聚并均质化的子批次装到 ReadyToProcess Capto S ImpAct 0.8 L 层析柱上。同样分两个循环将从 Fibro PrismA 规格汇聚并均质化的子批次装到 ReadyToProcess Capto S ImpAct 0.8 L 层析柱上。总共执行了 4 个循环的 Capto S ImpAct 步骤。每个循环中的层析柱载量为 74 至 76 g 抗体/L 填料,相当于评估的 QB10 的 70%。表 4 为层析法。从 UV280 上坡 100 mAu 时收集洗脱峰,在洗脱峰下坡降至 500 mAu 时停止收集。
捕获步骤剩下了一些材料,存储在 2-8°C 的冷藏室中,供以后的研究使用。这是由于在培养过程中产生了比最初预期更多的材料,并且 Capto S ImpAct 层析柱的装载量有限。
表 4. Capto S ImpAct 层析法
| 描述 | 缓冲液 | 柱体积 (CV) | 流速(停留时间) |
| 平衡 | 50 mM 乙酸钠,50 mM NaCl pH 5.0 | 5 | 5.4 分钟 |
| 负载 | 已调整的 VI 池,pH 5.0 ± 0.2 | 不适用 | 5.4 分钟 |
| 洗涤液 | 50 mM 乙酸钠,50 mM NaCl pH 5.0 | 5 | 5.4 分钟 |
| 洗脱液 | 50 mM 乙酸钠,200 mM NaCl pH 5.0 | 7 | 5.4 分钟 |
| 条带 | 1 M NaCl | 3 | 5.4 分钟 |
| CIP | 0.5 M NaOH | 3 | 5.4 分钟 |
| 再平衡 | 50 mM 乙酸钠,50 mM NaCl pH 5.0 | 5 | 5.4 分钟 |
| 存储* | 20% EtOH | 不适用 | 5.4 分钟 |
*仅当天的最后一个循环
从阳离子交换器洗脱后,对每个单独的产品池进行采样,然后添加调节缓冲液(比例 4:1)瞬间稀释,并将 pH 值调整至 Q 膜吸附器的装载条件(pH 6.0,电导率 10 mS/cm)。控制调整后的 Capto S Impact 洗脱液的 pH 值和电导率,然后直接装到 ReadyToProcess Q 膜吸附器上。
调整后的每个 Capto S ImpAct 子批次单独装入 Q 步骤,总共执行 4 个阴离子交换器循环。每个循环中的膜载量为 127 至 137 g 抗体/L 膜。表 5 为层析法。从 UV280 上坡 100 mAu 时收集流通峰,在流通峰下坡降至 100 mAu 时停止收集。
表 5. Adsorber Q 层析法 pH 6.0
| 描述 | 缓冲液 | MV | 流速 (L/h) |
| 平衡 | 50 mM 乙酸钠,pH 6.0 | 20 | 120 |
| 负载 | 调整后的 Capto S ImpAct 洗脱液 | 不适用 | 120 |
| 洗涤液 | 50 mM 乙酸钠,pH 6.0 | 10 | 120 |
| 条带 | 1 M NaCl | 5 | 120 |
| CIP | 1 M NaOH | 5 + 30 分钟保持 | 120 |
| 再平衡 | 50 mM 乙酸钠,pH 6.0 | 20 | 120 |
| 存储* | 20% EtOH | 不适用 | 不适用 |
*仅当天的最后一个循环
UF/DF 和最终过滤
对 Q 膜吸附器步骤产生的最终纯化材料进行浓缩,并将缓冲液更换为制剂缓冲液。汇集 ReadyToProcess MabSelect PrismA 层析柱和 Fibro PrismA 工艺流程产生的两个子批次,再转移到与 ÄKTA readyflux 相连的产品袋中。分别对源自不同捕获格式的两种材料在超滤/洗滤 (UF/DF) 步骤中进行处理,生成两种最终产品。
在浓缩和洗滤工艺中使用 UFP-30-C-9A 中空纤维滤器 30 kDa,1.15 m2,每个批次使用一个新滤器。
UF/DF 工艺由 UNICORN 自动运行,并包括正常透水性 (NWP) 测试、用缓冲液平衡滤器、将产品转移到系统产品袋、初始浓度达到 5 L,然后使用制剂缓冲液进行 6 体积的洗滤。更换缓冲液后,将产品从系统倒入 5 L 袋中。用 1 L 制剂缓冲液冲洗滤器和系统,然后将其倒入同一个 5 L 袋中以最大程度地提高回收率。工艺数据见表 6。由于第一批的 TMP 被认为有点高,因此略微调整了第二批的进料流量。
使用泵和 ULTA Pure HC 0.6/0.2 µm 囊式滤器将最终回流液过滤到存储袋中。在 2-8°C 下存储最终材料。
表 6. UF/DF 工艺运行参数
| 子批次 | 滤器负荷 (g/m2) | 剪切率 (1/s) | 进料流量 (L/min) | TMP (bar) |
| 批次 1 | 90 | 8000 | 10.8 | 1.7 ± 0.1 |
| 批次 1 | 90 | 8000 | 10.8 | 1.7 ± 0.1 |
| 批次 2 | 91 | 7400 | 10.0 | 1.2-1.3 |
分析方法
使用 Cedex™ Bio 测定细胞上清液中 mAb8 在工艺中的浓度,以便能够调整和适应捕获步骤的负载量。使用 Biacore 系统测定细胞上清液和所有其他工艺中间体中 mAb8 的浓度,用于回收率计算。使用 280 测定精纯步骤中 mAb8 在工艺中的浓度,计算
使用 Gyrolab 技术分析 HCP 和残留蛋白 A。使用 qPCR 分析 DNA。通过计算膜过滤和孵化后琼脂板上的菌落形成单位来分析生物负荷。通过测量对硝基苯胺的水平(在 405 nm 下)确定内毒素水平。
Products used
| Description | Product code |
| XDX storage bag 200 L, 3 port | 888-1259-F |
| XDM-200 PLUS Bag | 888-0155-C |
| ÄKTA readyflow kit with ReadyMate | 29007855 |
| ÄKTA readyflux flow kit plus | 29187382 |
| ULTA Pure HC 0.6 / 0.2 µm 2" Capsule Filter, 6" of tubing | 12410093 |
| ULTA Pure HC 0.6 / 0.2 µm 4" Capsule Filter, 6" of tubing | 12410094 |
| ReadyCircuit RMRM Jumper 5 ft | 12410116 |
| ReadyCircuit Jumper T Manifold, 6 ports, 6" of 0.5" tubing | 12410183 |
| ReadyCircuit Jumper Y Manifold, 3 ports, 6" of 0.5" tubing | 12410191 |
| Cellbag bioreactor 2 L | CB0002L11-31 |
| Cellbag bioreactor 10 L | CB0010L11-31 |
| Sensor Assembly with a Scilog pressure sensor and 6 in (152 mm) of AdvantaPure™ Reinforced Silicone 0.375 in (10 mm) ID tubing terminating with ReadyMate connectors. | 28979471 |
| ReadyCircuit 20 L Hanging/Pillow Bag, needleless CLAVE sample port, 4 ports, 1 ft of C-Flex® 374 0.5" | 12410225 |
| ReadyCircuit 50 L Pillow Bag, with a needleless CLAVE sample port, 4 ports, 1 ft of C-Flex 374 0.75" | 12410229 |
| Fibro PrismA 160 mL prototype | n/a |
| ReadyToProcess PrismA column 0.8 L (80/150) | 29420989 |
| ReadyToProcess Capto S ImpAct 0.8 L (80/150) | 29287577 |
| ReadyToProcess Adsorber Q 400 4 mm | 17372109 |
| ReadyCircuit PSIL jumper | 28979432 |
| ReadyCircuit 5 L Hanging/Pillow Bag, needleless CLAVE sample port, 3 ports, 1 ft of C-Flex® 374 0.375" | 12410220 |
| ReadyCircuit 10 L Hanging/Pillow Bag, needleless CLAVE sample port, 3 ports, 1 ft of C-Flex®374 0.5" | 12410222 |
| ReadyMate connectors mini TC 50 pieces | 28936707 |
| ReadyMate connectors TC 50 pieces | 28956890 |
| UFP-30-C-9A hollow fiber filter 30 kDa, 1.15 m2 | RTPUFP-30-C-9S |
| 50 mm TC clamp | 56410668 |
| 25 mm TC clamp | 56410666 |
| XDX storage bag 500 L, 3 port | 888-1260-F |
| Syringes, 20 mL and 50 mL | N/A |
| Description | Product code |
| XDX storage bag 200 L, 3 port | 888-1259-F |
| XDM-200 PLUS Bag | 888-0155-C |
| ÄKTA readyflow kit with ReadyMate | 29007855 |
| ÄKTA readyflux flow kit plus | 29187382 |
| ULTA Pure HC 0.6 / 0.2 µm 2" Capsule Filter, 6" of tubing | 12410093 |
| ULTA Pure HC 0.6 / 0.2 µm 4" Capsule Filter, 6" of tubing | 12410094 |
| ReadyCircuit RMRM Jumper 5 ft | 12410116 |
| ReadyCircuit Jumper T Manifold, 6 ports, 6" of 0.5" tubing | 12410183 |
| ReadyCircuit Jumper Y Manifold, 3 ports, 6" of 0.5" tubing | 12410191 |
| Cellbag bioreactor 2 L | CB0002L11-31 |
| Cellbag bioreactor 10 L | CB0010L11-31 |
| Sensor Assembly with a Scilog pressure sensor and 6 in (152 mm) of AdvantaPure™ Reinforced Silicone 0.375 in (10 mm) ID tubing terminating with ReadyMate connectors. | 28979471 |
| ReadyCircuit 20 L Hanging/Pillow Bag, needleless CLAVE sample port, 4 ports, 1 ft of C-Flex® 374 0.5" | 12410225 |
| ReadyCircuit 50 L Pillow Bag, with a needleless CLAVE sample port, 4 ports, 1 ft of C-Flex 374 0.75" | 12410229 |
| Fibro PrismA 160 mL prototype | n/a |
| ReadyToProcess PrismA column 0.8 L (80/150) | 29420989 |
| ReadyToProcess Capto S ImpAct 0.8 L (80/150) | 29287577 |
| ReadyToProcess Adsorber Q 400 4 mm | 17372109 |
| ReadyCircuit PSIL jumper | 28979432 |
| ReadyCircuit 5 L Hanging/Pillow Bag, needleless CLAVE sample port, 3 ports, 1 ft of C-Flex® 374 0.375" | 12410220 |
| ReadyCircuit 10 L Hanging/Pillow Bag, needleless CLAVE sample port, 3 ports, 1 ft of C-Flex®374 0.5" | 12410222 |
| ReadyMate connectors mini TC 50 pieces | 28936707 |
| ReadyMate connectors TC 50 pieces | 28956890 |
| UFP-30-C-9A hollow fiber filter 30 kDa, 1.15 m2 | RTPUFP-30-C-9S |
| 50 mm TC clamp | 56410668 |
| 25 mm TC clamp | 56410666 |
| XDX storage bag 500 L, 3 port | 888-1260-F |
| Syringes, 20 mL and 50 mL | N/A |