与分批式工艺和补料分批工艺相比,灌流工艺通过不断为细胞提供新鲜营养,同时清除用过的培养基和废物,能够实现长时间的连续运行。灌流工艺的主要优势在于紧凑的工艺设计、灵活性、更高的生产率、更高的产率和一致的产品质量。
所述研究的目的是演示使用与 Xcellerex 自动灌流系统 (APS) 集成的 Xcellerex XDR 50 实现连接的 mAb 灌流细胞培养工艺。工艺目标是在封闭和连接的工艺中达到 70 MVC/mL 的细胞浓度和 90% 以上的细胞活力并持续 10 天。此外,延伸目标是使细胞收获液向收获保持袋输送每天平均 0.72 g/L 的 IgG 滴度,并保持 20 pL/细胞/天的细胞特异性灌流速率 (CSPR)。
连接式灌流工艺动力学
可以使用多种方法来操作灌流细胞培养物以便将细胞和产物保留在培养物中。这些技术有的基于靶细胞的大小或密度,有的基于要分离的蛋白。连续离心机、交替切向流过滤、旋转过滤器、重力沉降器和声波分离之类的设备被用作细胞截留设备。每种技术都有其优点和缺点,但是,选择正确的系统是关键。
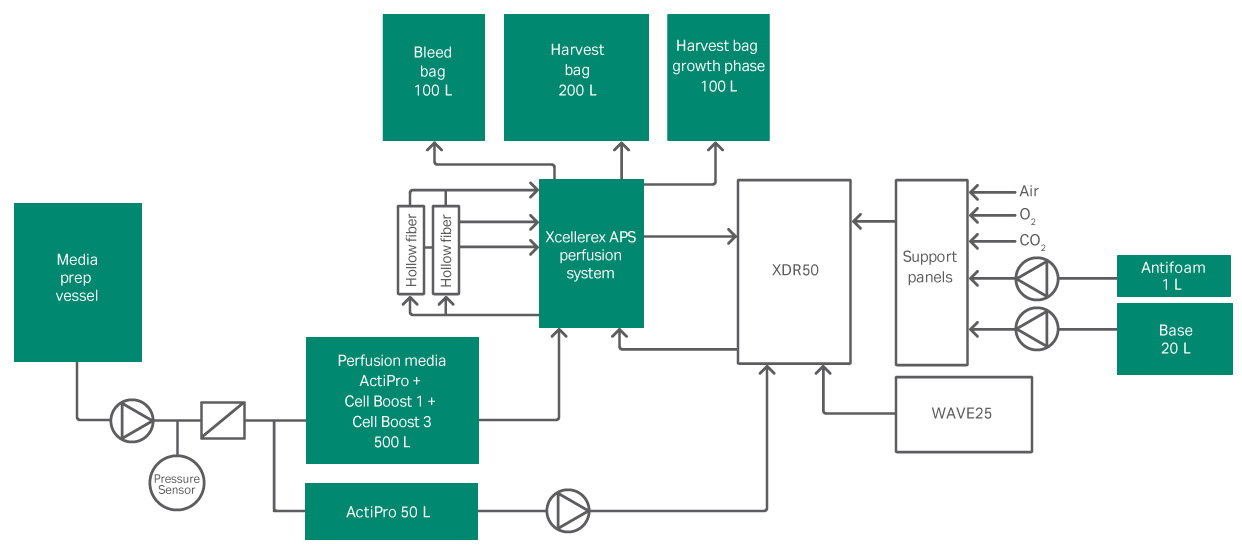
在本研究中,Xcellerex APS 利用微滤器 (MF) 作为细胞截留方法。所提出的基于切向流过滤 (TFF) 的系统包括一个低剪切泵,可以使工艺流体通过中空纤维过滤器再循环并返回到生物反应器。用于添加灌流培养基、透过液收集和细胞渗出的泵由反馈控制器进行调节。一次性压力传感器可以连续在线监测跨膜压力 (TMP) 和 delta P,以预测过滤器性能。流量传感器和称重计用于严格控制剪切速率,添加新鲜培养基和去除废培养基。该系统具有以下优点:设置简便灵活、工艺流体在再循环回路中的停留时间短、HF 过滤器自动切换到备用过滤器,另外可添加自动化功能严格精确地控制灌流。为了进一步提高效率,本项目的范围是在连接的一次性 50 升生产线中执行整个工艺。
材料和方法
在本研究之前,进行了概念验证研究以开发和优化操作参数。可以在此处找到有关小规模研究的更多信息。
在研究的整个过程中,使用了重组中国仓鼠卵巢 (CHO) K1 细胞系在谷氨酰胺合成酶 (GS) 选择系统下产生 IgG1 抗体。在初始批量培养阶段,细胞从冷冻保存状态中回收,使用摇瓶在 HyClone ActiPro 基础培养基中扩增。在 WAVE 25 生物反应器中将种子最终扩增至 10 升。操作参数见表 1。
对于灌流操作,选择补充了 HyClone Cell Boost 1 和 HyClone Cell Boost 3 的 HyClone ActiPro 基础培养基。对多种培养基和补料组合进行了广泛的培养基优化研究,以确定 CHO K1 细胞系稳态灌流的理想条件。可以在此处查看这些研究的更多详细信息。ActiPro 与 Cell Boost 1 和 3 的组合最适合此特定细胞系,但我们建议由细胞培养基开发服务团队协助确定特定细胞系的最佳组合。
一旦达到设定的细胞浓度,就会启动灌流工艺。灌流工艺使用图 1 所示的连接装置进行。可在表 2 中查看灌流操作的操作参数。使用表 3 中的参数通过 Xcellerex APS 连续执行细胞收获液的澄清和产物的收集。产物收集在 XDM 200 存留罐中,以进行进一步的下游处理。
表 1. WAVE 25 接种物生物反应器的操作参数
| 参数 |
设置/备注 |
| 介质 | ActiPro |
| 反应器类型 | 带有 ReadyToProcess WAVE 25 的 Cellbag 20L |
| 摇摆 | 22 至 25 rpm 6° 摇摆角度 标准摇摆曲线 |
| 气体流量 | 0.25 LPM |
| 种子细胞浓度 | 0.7 × 106 个活细胞/mL |
| pH 值设定点 | 低容量阶段:无 pH 值控制(初始 7.5% CO2 在顶空) 全容量阶段:pH 值控制在 7.0(无碱) |
| DO 设定点 | 40%(从 100% 漂移) |
| 工作容量 | 前 2 天为 2 L,然后为 5 L,最后为 10 L |
| 转移时的靶细胞浓度目标 | 6 × 106 个活细胞/mL |
| 转移时的活力标准 | > 95% |
表 2. 生产阶段生物反应器的操作参数
| 参数 |
设置 |
| 培养配液量 | 50 L |
| 灌流策略 | 细胞达到 2-4 MVC/mL 时开始灌流 保持 20 pL/细胞/天的灌流速率。 通过细胞渗出在 70 MVC/mL 下保持稳态,持续 10 天 |
| 温度设定点 | 37°C |
| pH 值设定点 | 7.0(第 0 天) 6.8(第 1 天及以后) |
| DO 设定点 | 40% |
| 目标接种细胞浓度 | 1 MVC/mL |
| Do 喷射速率 | 第 0 天到大约第 4 天 (ca 8 MVC/mL): 20 µm 喷射器,按需供气 第 4 天及以后: 20 µm 喷射器,按需提供额外 100% 氧气 |
| CO2 汽提策略 | 从 1 SLPM 开始。以 0.5 SLPM 的幅度增加,使 pCO2 保持在 20 kPa 以下 |
| 目标活细胞浓度 | 70 MVC/mL(受控状态) |
| 目标活力 | > 90% |
| 培养持续时间 | 在受控状态下 10 天 |
| 培养基 | 扩增批次培养的培养基:ActiPro 灌流培养基:ActiPro,13.94% Cell Boost 1(10% w/v 储备液),15.80% Cell Boost 3(5% w/v 储备液) |
表 3. Xcellerex APS 的操作参数
| 灌流工艺运行参数 |
设定点 |
| 流路调节流速 | 5 LPM |
| 灌流再循环流速 | 6 LPM |
| 剪切率 | 2000 ±100 s-1 |
| CSPR 速率 | 20 pL/细胞/天 |
| 渗出速率 | 基于生物量传感器 (mLPM) |
| 过滤器切换 TMP | 0.8 bar |
图 1. 使用 Xcellerex XDR 50 和 Xcellerex APS 的试验装置。
结果
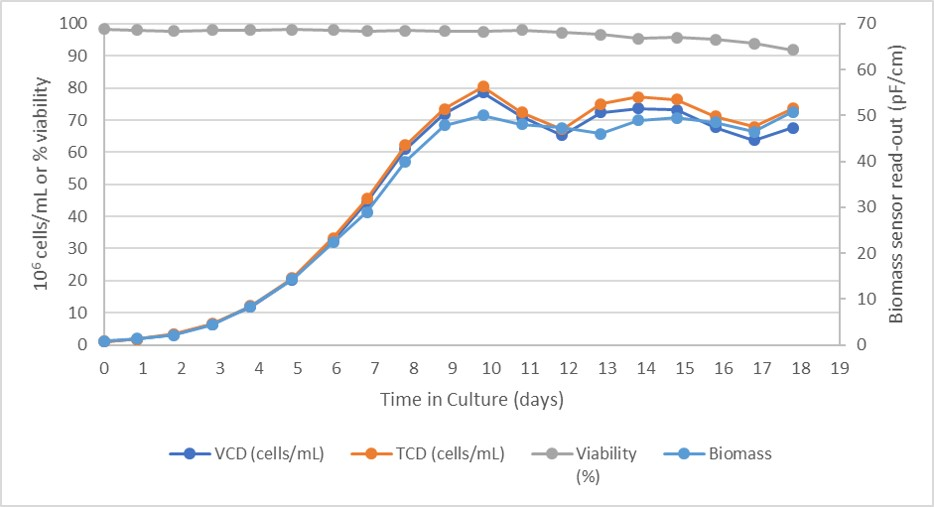
批次用 1.0 × 106 个细胞/mL 的种子密度接种以使细胞适应新环境,缩短滞后阶段并可以尽早开始灌流阶段。培养物在最初的五天内具有一个初始的快速生长阶段,群体倍增时间 (PDT) 平均为 30 个小时,随后是慢速生长阶段,直到第 7 天达到受控状态(图 2)。
在第 7 天,根据生长速率、反应器容积和 VCD 值,通过连续细胞渗出启动稳态工艺。Xcellerex APS 自动控制细胞渗出。灌流控制策略基于恒定的 XDR 重量,精度范围为 ± 200 g。在此策略中,灌流培养基的添加受到严格控制,准确且可预测,而透过液收获受到控制以保持稳定的 XDR 重量和工艺。从前期研究中就已经知道,使用一两个每日离线样本数据点是不可能建立受控状态的。Xcellerex XDR 50 在线生物量传感器提供了必要的数据,用于控制渗出速率并使生物反应器保持受控状态。
图 2. Xcellerex XDR 50 生物反应器中的细胞生长和活力。
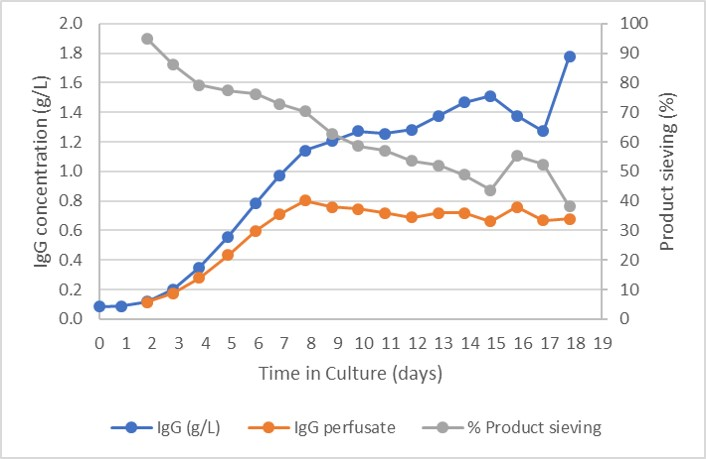
图 3 显示了产物浓度,包括生物反应器以及灌流液中的产物浓度。该图显示,由于产物滞留,产物在生物反应器中随着时间而积累。指数生长阶段的产物浓度为 668 mg/L,在受控状态下达到峰值 985 mg/L。CSPR 速率保持在 20 pL/细胞/天。
图 3. 生物反应器、灌流液和产物筛分中的产物浓度。
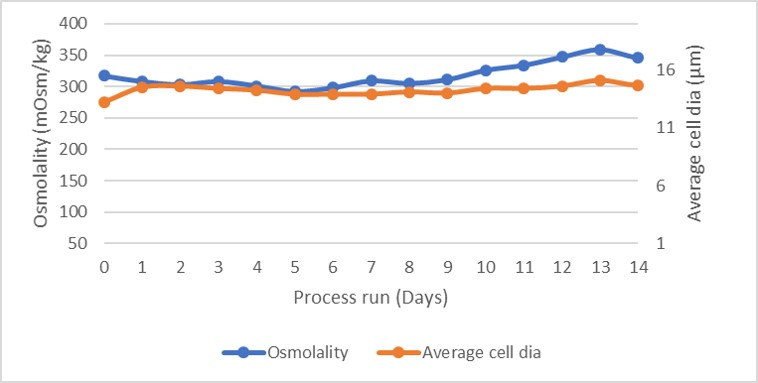
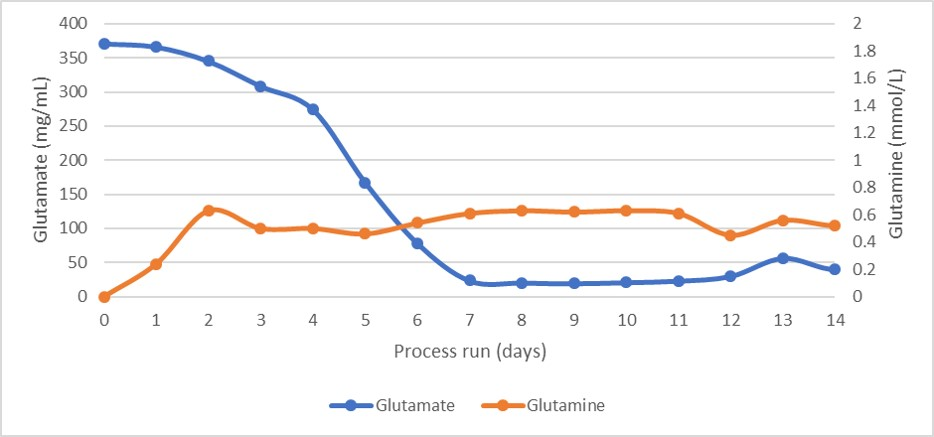
培养物的渗透压和平均细胞直径分布如图 4 所示。渗透压分布很稳定,表明营养物质的补料和废物的去除非常均衡,否则未消耗的营养物质将会增加渗透压。如图 4 中的谷氨酸盐和谷氨酰胺分布曲线以及图 5 中的乳酸盐和氨分布曲线所示。
图 4. 渗透压和平均细胞直径分布。
图 5. 灌流细胞培养过程中的谷氨酸盐和谷氨酰胺浓度分布。
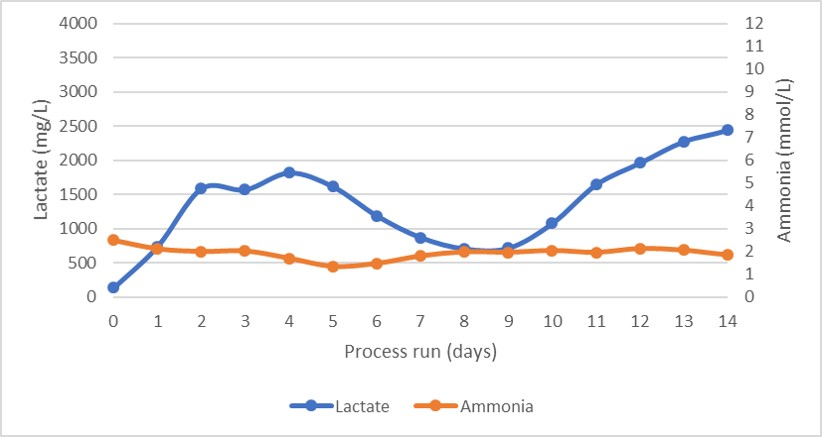
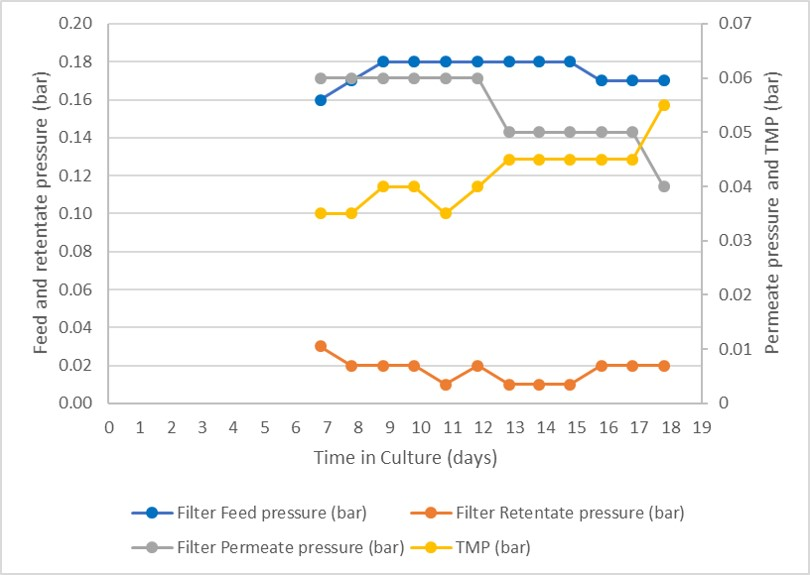
在工艺运行期间监控补料、回流液和透过液的压力,图 6 中报告了得到的 TMP。可以看出,整个过程中所有压力都保持恒定,仅在第 10 天后 TMP 才开始上升。这表明在整个运行过程中使用的单个过滤器只发生了有限的过滤器结垢。
对样本进行了生物负荷测试,在分析的大多数中间体中均未检测到活微生物,并且收集的所有样本的内毒素水平均低于检测极限。对于其中的两个样本,报告了 1 CFU,而重复样本为阴性。导致阳性结果的原因很可能是取样或测试错误,且阳性结果没有对比内毒素结果或第二份样品予以证实。
图 6. 乳酸盐和氨的生产分布
图 7. 灌流工艺期间的压力分布。
结论
研究结果表明,使用与 Xcellerex XDR 50 生物反应器系统集成的 Xcellerex APS,可以在连接的工艺中成功地培养出具有高细胞密度的连续灌流细胞培养物。在本研究中,我们能够成功进行 18 天的灌流细胞培养,细胞活力大于 90%。在其中的 10 天中,将灌流细胞培养物保持在 70 MVC/mL 的受控状态。此外,细胞收获液以 0.72 g/L 的每天平均 IgG 滴度输送到收获保持袋中,并保持 20 pL/细胞/天的 CSPR。
在演示的运行中,使用一次性 (SU) 流路、XDR 50 生物反应器袋和 ReadyToProcess 组件将 XDR APS 灌流系统与 XDR 50 生物反应器集成在一起。连接的 SU 流路消除了交叉污染,并减少了批次转换时间。在工艺运行后,所有液体接触部件都可以方便地进行处理。系统通过 Wonderware 软件提供了广泛的监测和控制功能。
参考文献
- Mayrhofer, P., Reinhart, D., Castan, A. and Kunert, R. Rapid development of clone‐specific, high‐performing perfusion media from established feed supplements.Biotechnology Progress; 36(2).