FDA 的现行药品生产质量管理规范 (cGMP) 法规是指导生产安全有效的生物制品的关键因素。当生产商遵守 cGMP 法规时,用于生产产品的工艺、设施、设备和控制措施将始终如一地生产出优质的人用药物。《美国联邦法规 (CFR)》第 21 编第 210 和 211 部分以及第 600 - 680 和第 820 中的适用要求概述了生物制药生产的最低要求。该要求包括对人员、设施、设备、组件、工艺、测试、包装、标签、仓库和配送的控制措施。控制措施的可追溯性是确保符合所有 cGMP 要求的一个关键方面。
随着行业的持续增长和发展,在一些独特的环境中正在孕育着先进的疗法。该独特的环境包括医院、转化中心和小规模的生产中心。同时,在开发先进疗法的过程中,新的工艺也在发展(比如对患者自身细胞进行基因改造)。这给 cGMP 合规性带来了重大挑战,因为这些研发生产的场所和工艺可能不具备可监控、可保障在生产的能力。即使是拥有 cGMP 设施的生物制品生产商,也难以完全保障针对细胞疗法的原始细胞材料从抵达其生产场所再到成品运输至临床端这一过程中生产设施的稳定性、可追溯性和生产进程。简化前沿药物的日常管理,并确保持续生产对行业的未来至关重要。因此,随着自动化不断为生物制品生产的灵活性和优化生产提供新的选择,探索其在先进疗法生产方面的应用并进而提高安全性、质量和合规性成为了推进患者护理的一个关键因素。
细胞疗法生产:今天和明天
由于使用活的组织、细胞来进行药物的生产,这种生物药的生产一直面临着独特的挑战。而与通过化学反应生产药物相比,有机体不断变化的性质也使得更难以保证一致性。在细胞疗法生产中,这些障碍被放大,因为最终产品不能灭菌,因此生产过程中保证无菌是一个关键的工艺属性。人为干预(不管是通过开放式操作步骤,或是通过在工艺中去除样本)会给细胞疗法带来可变性和污染风险。因此,手动工艺操作可能会产生污染,并导致疗法不一致。
同时,自体细胞疗法还要求在所有工艺步骤期间进行追溯,以确保患者自身的细胞被回输。未来按照 cGMP 生产这些疗法的一个主要考虑就是将自动化、封闭式系统生产技术与电子系统相结合,以便进行记录保存、工艺控制和审核追踪。封闭式系统和自动化工艺能够实现更高的污染控制和生产一致性。此外,电子记录系统还会自动记录,实现追溯并提高系统性能。
在如今的细胞疗法生产中,许多手动步骤都要耗费大量时间。例如,根据以往的开发工作,典型的工作流程包括要等够细胞增殖和群体倍增的平均天数。之所以要等待,就是因为多个点同时收集不同批次的样品可能会危及无菌性原则。而通过封闭的系统监控整个生产工艺使得员工能够跟踪操作。该系统还允许员工实时观察细胞的健康状况和工艺的一致性,从而识别和控制可能影响最终产品的任何情况。更好地监控这些参数将有助于复制高质量的生产工艺。最终,如果自动化系统能够提供无菌屏障,并且在整个过程中保持关键的工艺参数,也可以显著节省时间和成本。
虽然具备以上能力的生产执行系统 (MES) 已被用于如今的生物工艺,但通常成本高昂。而小规模生产疗法或临床试验开发所面临的成本可能过高。此外,生物工艺 MES 并非专门为细胞疗法生产而设计,在细胞疗法生产中,跟踪细胞系的监管链对于正确处理个性化药物至关重要。作为一家致力于为生物制药提供高级解决方案和应用支持的供应商,我们最近推出了 Chronicle 自动化软件。它是细胞疗法平台工程师开发的首个细胞疗法生产方案。Chronicle 旨在帮助优化复杂的细胞疗法工艺,同时证明监管合规性,为快速采用创造途径。了解软件的功能及其带来的好处可能是在你的工厂实施自动化系统的关键。该系统将简化复杂的工艺,并确保工艺为患者提供一致且合规的治疗。
Chronicle 细胞疗法自动化软件
开发和生产细胞疗法至关重要,需要高度的谨慎和效率。如果在生产期间,患者的细胞材料出现任何问题,应由合适的安全团队处进行处理。建立工艺保障系统可以降低成本,提高生产通量,更能有效支持技术人员同时满足患者的回输剂量的需求。
降低风险:通过报警、检测和电子SOP实现风险控制
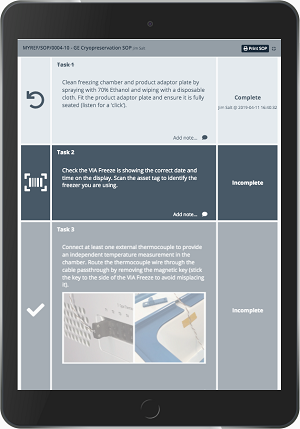
Chronicle用户可从这个统一的数字化平台中受益,在该平台用户可以使用标准操作程序(SOP)来进行实时数据的采集和报警,用于监测生产进程和供应链中的各种要素。因为 Chronicle 是一个基于软件的网络应用程序,针对智能手机和平板电脑进行了优化,因此,警报会以短信或电子邮件的形式发送给特定的用户。然后用户可以立即在系统中响应回复,进而解决该问题。创建电子化的SOP(eSOP;图1)可以使用户利用数字化的巩固来跟踪知道整个批次中的生产操作。
图 1. Chronicle 软件的电子标准操作规程 (eSOP) 示例。
收集并存储真正的自动化批次记录
Chronicle 还通过自动化批次记录提高效率。一个疗法的批次记录可能长达数百页。这些页面通常必须通过手动编写、审查和匹配来实现可追溯性。但是,Chronicle 可自动记录生产中的各种要素,比如执行的工艺步骤和工艺偏差等。该软件还会记录产品信息,包括批号和有效期。它可以自动扫描耗材(图 2)、样本和仪器上的二维码,包括来自连接设备的详细数据。然后,Chronicle 会将所有数据储存在一个空间无限的安全云中。用户可收集、保存和存档这些电子批次记录供以后访问,从而确保以后多年可追溯,满足法规要求。
图 2. 操作员通过扫描试剂标签识别批号和有效期。
快速启动和运行
Chronicle 属于 GAMP™ 5 三类软件,这意味着其开发的目的在于满足被监管公司的具体需求 (1)。安装该软件需要的时间周期短,往往是几天甚至是几小时。此外,Chronicle还可以实现与第三方设备的集成化连接,并可帮助跨国制造环境中的多个角色进行访问交互。例如,质量团队可以查看发生了多少偏差,以及是否满足对设备使用人员的培训要求;供应链专家可以监控一段时间内使用的耗材数量、耗材的失效日期以及处理方式;物流团队可以检查队列中的货物数量以及已经使用的数量。
此外,Chronicle 软件采用按次收费的模式,费用取决于你计划处理的批次数量,可能是商业规模的大批次,也可能是小批次。例如,Vanderbilt-Ingram 癌症中心最近与我们合作,利用自动化和数字化工作流程来提高细胞处理操作的生产率,其中就用到了 Chronicle 软件。该系统随你和你的需求一起成长,具有灵活性,这对于像细胞疗法这样快速扩张的市场来说至关重要。
伴随您和行业发展的需要而扩展功能
Chronicle 适合非 cGMP 和 cGMP 双重环境。它为研究或开发工作提供一个不断成长、简单且灵活的方案。当时机成熟,你就可以扩展和锁定工艺,进行高效、一致的生产管理,甚至横跨多个大洲管理数千个互联单元。随着规模的扩张,保持生产的一致性,对任何药品生产商乃至整个行业都至关重要。核心意义在于,这种可以推动符合cGMP准则的生产工艺发展的技术,必须跟的上用于拯救生命的药物研发的发展速度。例如,以前是使用鸡蛋生产新疫苗,现在已经发展为更加一致和高效的细胞培养生产。随着新生产系统和技术的开发,细胞疗法生产也在不断发展。使用患者的细胞来预防、诊断和治疗疾病已经为治疗癌症和各种罕见疾病提供了激动人心的新机会。科学的进步已经给许许多多需要帮助的患者带来了希望。通过推进我们的生产技术,新疗法的安全与持续性的生产才能有更好的保障,科学的进步才能发展的更顺利、更快!
了解更多有关 Chronicle 生产自动化软件的信息。
参考文献
- AmpleLogic i-QMS.Brief on GAMP 5 Categories, V Model and 21 CFR Part 11, EU Annex 11 (2018).【在线。】https://www.amplelogic.com/blogroll/brief-on-gamp-5-categories-v-model-and-21-cfr-part-11-eu-annex-11/.访问日期:2019 年 10 月 29 日。