本文改编自最初发表于 https://www. cellculturedish.com 的赞助内容
COVID-19 疫情期间,Pfizer/BioNTech 和 Moderna 迅速推出了高效疫苗(有效性94-95%),使 mRNA 疫苗成为人们关注的焦点。在SARS-CoV-2 的序列公布之后,Moderna 仅在 28 天内就研制出了第一批候选药物(1)。短短几个月就完成了全部临床1-3 期试验并推出数百万剂疫苗,速度之快,是其他疫苗从未有过的 (2)。
除了极短的开发时间和高效的疗效之外(至少对于 COVID 是如此),预防性和治疗性疫苗采用 mRNA 平台还有其他优势 (3):一是安全配置,抗原的表达通常只需要几天的时间,并且可以通过 mRNA 的设计进行调节,相对于减毒疫苗和载体疫苗,mRNA 疫苗更加可控。与基于 DNA 平台的方法不同,mRNA 疫苗不需要进入细胞核,因此基因组整合和诱变的风险较低。其次,mRNA 疫苗能够稳健的促进细胞免疫和体液免疫反应,并且可以通过 mRNA 的设计、递送系统的选择或其他方法在一定程度上调控免疫反应水平。
mRNA疫苗在生产环节也具有优势,其合成是基于无细胞反应体系中成熟的体外转录过程(图 1),该反应体系可以显著减低成本,在时间和生产场地方面都具有显著优势。用于 mRNA 转录的质粒 DNA(pDNA)模板的生产,是基于细胞的发酵,但这也不是一个高成本或耗时的步骤。此外,mRNA 的生产更具灵活性,例如变异疫苗或多价疫苗通常可以在不对工艺进行重大变更的情况下进行生产。
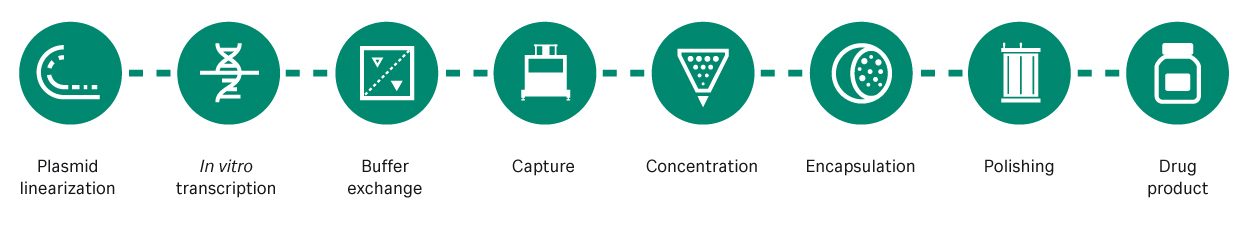
图 1. mRNA 生产工艺。mRNA 从线性化的 pDNA 模板中转录出来,然后进行捕获、浓缩、封装和纯化以交付给患者。
简单来说,mRNA 疗法是一种非常令人鼓舞的新兴疗法,但其仍需要进一步的改进才能趋向于成熟,尤其是在生产、系统管理和供应链领域。
由于mRNA带负电荷,无法轻易进入细胞,且可以被 RNase 等核酸酶迅速降解。目前 mRNA 疫苗中使用的是基于脂质纳米颗粒 (LNP)的方法 ,该递送系统可以很好的解决这一问题,其他进行碱基修饰或 mRNA 设计的方法也是这个目的。或者可以采用物理方法,例如电穿孔,这种方法在体外给药的治疗性癌症疫苗中得到了广泛的应用,但效率较低。
另外一个需要关注的是疫苗供应,因为目前的 mRNA 疫苗需要冷冻储存,而冻干等替代方法还在研究当中 (4)。 疫苗的生产也存在一些问题,与传统重组蛋白相比,mRNA 工艺的主要挑战之一是:缺乏适合专门针对大分子mRNA生产的小体积设备和耗材。此外,在可扩展性和工艺一致性的技术开发方面,还存在着一定的改进空间。
基于 RNA 的疗法的趋势
1990 年,科学家们将未包裹的mRNA直接注射到小鼠骨骼肌后,观察到了蛋白质在体内进行表达之后,mRNA 疫苗的潜力就受到科学界的关注 (5)。此后,该行业迅速发展壮大,直到今天,有超过 140 项临床试验着眼于 mRNA 在传染病、癌症和其他各种应用领域的应用。
目前有两种形式的 mRNA 结构正在被开发当中:非复制型 mRNA 和自扩增 mRNA。非复制型 mRNA 疫苗即传统的 mRNA 形式,不具有 mRNA 序列的自我复制能力。抗原序列的两侧是非翻译 (UTR) 区域,3' poly(A) 尾和 5' 帽,可被设计为上调或下调表达,用于调节免疫反应 (4)。修饰的核苷酸(如假尿苷和 5-甲基胞苷)可用于减少不良的先天免疫系统反应并提高翻译效率 (2,4)。因此,很多临床反应都可以通过简单的 mRNA 的设计进行调节。
非复制型 mRNA 疫苗本质上是短暂的,通常在几小时或几天内完成抗原表达(Pfizer/BioNTech 和 Moderna 疫苗的胞内半衰期估计为 8-10 小时)。对于某些应用领域,这可能是有益的,但是对于其他应用领域,如系统性蛋白质疗法,就需要延长蛋白质的表达。
使 mRNA 能够自我扩增的方法正在开发中(saRNA),这可以将表达时间延长至数周 (4-6周)。通常,saRNA 是加入来自甲病毒、黄病毒或小核糖核酸病毒的顺式或反式的病毒复制酶基因。这些策略可以提高表达水平或将 mRNA 的剂量要求降低 10 至 100 倍。saRNA 技术的发展将 mRNA 技术扩展到更多应用领域,同时降低生产需求。在众多正在开发的mRNA 技术领域的中,优化和 mRNA 设计是当前的重中之重。
除mRNA 之外的其他 RNA 疗法目前也正在开发中或已经获得批准。其中包括修饰基因表达的反义寡核苷酸;同样通过不同的机制修饰基因表达的小干扰 RNA (siRNA);可以结合其他配体(包括 RNA)的适体;以及用于 CRISPR 靶向的向导 RNA。其中许多 RNA 疗法与 mRNA 疫苗有着共同的重叠技术。例如,Alnylam 获批的 siRNA 治疗剂 Onpattro© 就采用了 LNP 技术 (2,3)。因此,除了 mRNA 疫苗之外, RNA治疗总体进展迅速。
基于 mRNA 的治疗类型
COVID 疫苗是针对传染病的预防性疫苗。针对流感、寨卡病毒、登革热、狂犬病和委内瑞拉马脑炎病毒以及葡萄球菌和结核病等细菌感染的其他预防性疫苗正在开发中 (4,6)。还有一些比较特别的包括:表达针对基孔肯雅病毒的中和单克隆抗体 (4)。
作为一种治疗癌症的方法,mRNA 疫苗也获得了广泛的关注。在治疗泛癌症的方法中,mRNA 可以引发对许多癌症中共有的突变癌基因或调节性癌基因(如 TP53)的免疫反应。
其他治疗癌症的方法包括个性化治疗,即针对人的个体突变开发疫苗。在这方面,患者的突变体组将通过下一代测序来识别,并针对个体的特定新抗原开发少量定制的 mRNA 疫苗 (7)。
治疗性癌症疫苗的开发进展迅速,目前已完成 70 多项临床试验,预计在未来 2-3 年内会有更多结果 (5)。正在评估的技术包括通过体外电穿孔 mRNA 直接刺激抗原呈递细胞 (APC)。其他方法包括直接肿瘤内注射、全身方法和靶向器官方法。目前,超过 50% 的使用 mRNA 的临床试验集中在治疗黑色素瘤、前列腺癌和脑癌 (5)。因此,尽管 mRNA 疫苗的许多应用正处于不同的开发阶段,但以 LNP 靶向特定器官、组织和细胞仍在研究中。
生产制造瓶颈
应用所需的 mRNA 数量因适应症、方法效力、需求和其他因素而异。定制的、个性化的应用可能只需要生产毫克量的 mRNA。而全球需求可能需要更大的 mRNA 生产能力。例如,目前的 Pfizer/BioNTech 和 Moderna COVID 疫苗分别含有 30 μg 和 100 μg 的非复制型 mRNA (1)。对于这些疫苗,生产 10 亿剂疫苗将需要生产 30-100 kg 高度纯化的 cGMP mRNA,最好通过每批至少几克的批次进行生产。
当前 mRNA 生产中最常见的瓶颈之一是生产规模问题。由于 COVID 产品已达到数十亿剂的规模,理所当然的需要更大规模的生产技术。我们看到有人对 Cytiva 的 FlexFactoryTM 平台和 KUBioTM 盒式解决方案都产生了浓厚的兴趣,它们可以为客户定制并交付完整的一套解决方案。这些解决方案已开发并交付用于 mAb 生产以及质粒和病毒载体生产。此外,小规模的cGMP 生产也有一定改进的空间,因为当前用于mRNA生产的大部分设备都是对现有生物技术设备的重新利用,其设计规模远远大于 mRNA 生产本身所需的规模。行业可以专为 mRNA cGMP 生产进行设备设计并从中中获益,包括较小规模的设备。
mRNA 的上游生产已经相当成熟。尽管可以购买体外合成 mRNA 所需的 cGMP 质量的质粒、聚合酶和酶,但成本可能很高 (5)。Poly(A) 尾可以通过包含在模板中或通过使用酶来构建 (4)。加帽可以选择高效的共合成试剂,例如 TriLink Biotechnology 的 CleanCap© 和高效的酶处理体系(4)。目前看来,尽管 mRNA 疫苗基于无细胞生产体系,理论上有可能比其他疫苗方法成本更低,但实际上它们的生产成本更高。为了改善整体的成本状况,需要降低 GMP 试剂、加帽试剂和专利(如 LNP)的成本。
质粒在 mRNA制造过程中被用作起始模板,与不断增长的病毒载体领域一样,其容量的限制是一个挑战。很多公司正在研究消除这一瓶颈的方法,围绕无细胞工艺质粒生产的新技术可能会改善这一初始工艺步骤。
然而,下游生产也是需要改进的。高纯度的 mRNA 是高效翻译和减少不良免疫反应所必需的 (5)。包括酶、核苷酸、质粒模板和异常 的RNA 在内的多种杂质需要多步纯化才能完成 (5),并且涉及多种正在开发的工艺,例如可以使用沉淀、亲和 oligo dT、含或不含纤维素的离子对色谱 (IPC)、离子交换色谱和切向流过滤 (TFF) 等技术 (5)。因此,替代纯化配体和更加精细的纯化方法将极大地有益于下游行业的发展。此外,分析方法也存在着进一步的改进空间。
虽然 mRNA 生产适合标准化和平台化,例如单克隆抗体药行业就是如此,但目前大部分的生产是使用专用设备分多个步骤进行的。其他方面,例如一次性工艺和连续流生产的策略,将为这个新兴行业带来更多利好消息。
mRNA 技术的研发生产速度和潜在成本收益使其成为备受关注的个性化医疗技术,可以针对人的个体癌症突变开发疫苗。许多公司正在为此开发集成的系统的 mRNA 工艺解决方案。尽管该工艺中的许多步骤是相同的,但规模和成本带来的挑战依然存在。但这一领域的发展仍在继续,未来可能会进入商业化阶段。
最后,需要对这一工艺的科学性有更深入的了解。例如,LNP 通常是在使用微流体装置 (2) 的快速混合过程中形成的,这更像是艺术,而不是一种成熟的方法。深入了解 LNP 成分的影响及其对 LNP 稳定性、交付、效率、免疫反应和最终患者结果的影响,将使该行业受益 (2)。LNP 和其他交付技术的优化是决定治疗最终成败的关键因素。
封装和递送技术
纳米结构(例如 LNP)的使用在 mRNA 治疗剂中很常见,因为它们通常比未包裹的mRNA 有更高的效率,并可以通过多种途径给药。纳米结构技术面临的一项挑战在于本质上的复杂性,它涉及许多潜在的成分,有许多可能的临床结果,我们对这方面的了解还不是很充分。纳米结构特性对临床结果至关重要,包括核酸保护、细胞内 RNA 的受控释放、细胞和组织选择性、翻译效率、毒性和长期稳定性等 (2)。
纳米结构很复杂,可能由多种成分组成,例如常见的脂质、聚合物、蛋白质、胆固醇或定制的专有成分,例如可电离脂质(3,4),通常使用聚乙二醇-脂质等偶联物。每个成分都会影响结构特性。例如,聚合物含量可以控制粒径,影响效率和细胞趋向性。结构脂质,如胆固醇,会影响颗粒稳定性。如果混合不正确,可能会形成没有有效载荷的空纳米粒。因此,纳米结构的组成和形成对于所需的临床效果至关重要 (2)。目前,LNP 是包括基因治疗在内的许多系统的主要非病毒递送系统 (2)。
还有其他交付方法正在研究和开发中。外泌体被认为可以用作一种受体,可能提供更有效的摄取效率、更高的特异性和更少的副作用 (8)。这是一个前景可观的早期研究领域。其他领域包括偶联 RNA,例如 GalNac-siRNA,经证明可以靶向肝细胞 (9)。同样,GALA 肽偶联 mRNA 经证明可改善 APC 的摄取 (10)。其他方法正在评估当中,以提高靶特异性或改善细胞摄取。
未包裹的 mRNA 已通过包括直接注射到肿瘤中等方法进行癌症治疗的评估。通常,未包裹的RNA 被认为不如其他方法有效,但因为它只需要缓冲液,因而很容易制备 (4,11)。在某些应用中,未包裹mRNA 固有的高免疫原性可能通过增强佐剂活性而得以改善 (11)。
mRNA 行业的前景
随着 COVID-19 疫情的到来,用来生产预防性疫苗的 mRNA 由于需求迫切而成为公众关注的焦点。这些疫苗凭借快速的开发时间和高的疗效已经证明了 mRNA 治疗方法的前景。
尽管 COVID 疫苗备受关注,但迄今为止研究的大多数 mRNA 疫苗都集中在癌症治疗方面,并且已经完成或正在进行数十项临床试验。许多正在进行的试验都是针对个性化治疗性癌症的疫苗,应该在未来 2-4 年内完成。该领域充满前景的期待可以进一步推动 mRNA 行业的发展。
此外,许多疗法正处于早期开发阶段,跨越了不同的领域,如果取得成功,将会产生巨大影响。mRNA 疗法的成功可能会取代其他效果较差的治疗方法,例如流感疫苗、结核病疫苗或其他应用疗法。
总结
mRNA 疗法是一个快速发展的领域,有太多的应用正在开发中,在这份简短的报告中无法面面俱到。由于mRNA疗法在灵活性、成本和开发速度方面的优势,该技术已经为传染病和个性化药物提供了巨大的益处和潜力。要充分发挥这项技术的潜力,仍需克服许多挑战,但 COVID-19 疫情已经向公众证明了 mRNA 疗法的前景:这个新兴行业的前景一片光明。
一键下载相关资料- Teo SP. Review of COVID-19 mRNA vaccines: BNT162b2 and mRNA-1273. J Pharm Pract. 2021(Apr 12);8971900211009650. doi:10.1177/08971900211009650.
- Kim J, Eygeris Y, Gupta M, Sahay G. Self-assembled mRNA vaccines. Adv Drug Deliv Rev. 2021 (Mar);170:83-112. doi: 10.1016/j.addr.2020.12.014.
- Schoenmaker L et al. mRNA-lipid nanoparticle COVID-19 vaccines: structure and stability. Int J Pharm. 2021 (May 15);601:120586. doi: 10.1016/j.ijpharm.2021.120586.
- Xu S, Yang K, Li R, Zhang L. mRNA vaccine era-mechanisms, drug platform and clinical prospection. Int J Mol Sci. 2020 (Sep 9);21(18):6582. doi: 10.3390/ijms21186582.
- Rosa SS, Prazeres DMF, Azevedo AM, Marques MPC. mRNA vaccines manufacturing: challenges and bottlenecks. Vaccine. 2021 (Apr 15);39(16):2190-2200. doi: 10.1016/j.vaccine.2021.03.038.
- Maruggi G, Zhang C, Li J, Ulmer JB, Yu D. mRNA as a transformative technology for vaccine development to control infectious diseases. Mol Ther. 2019 (Apr 10);27(4):757-772. doi: 10.1016/j.ymthe.2019.01.020.
- Vormehr M, Schrörs B, Boegel S, Löwer M, Türeci Ö, Sahin U. Mutanome engineered RNA immunotherapy: towards patient-centered tumor vaccination. J Immunol Res. 2015(2015);595363.doi: 10.1155/2015/595363.
- Tsai S-J et al. Exosome-mediated mRNA delivery for SARS-CoV-2 vaccination. Preprint at bioRxiv 2020 (Nov 6). doi: 10.1101/2020.11.06.371419.
- Springer AD, Dowdy SF. GalNAc-siRNA conjugates: leading the way for delivery of RNAi therapeutics. Nucleic Acid Ther. 2018 Jun;28(3):109-118. doi: 10.1089/nat.2018.0736.
- Lou B, De Koker S, Lau CYJ, Hennink WE, Mastrobattista E. mRNA polyplexes with post-conjugated GALA peptides efficiently target, transfect, and activate antigen presenting cells. Bioconjug Chem. 2019 Feb 20;30(2):461-475. doi:10.1021/acs.bioconjchem.8b00524.
- Zeng C, Zhang C, Walker PG, Dong Y. Formulation and delivery technologies for mRNA vaccines. Curr Top Microbiol Immunol. 2020 (Jun 2);10.1007/82_2020_217. doi: 10.1007/82_2020_217.